|
有机硼酸酯类化合物由于其相对稳定性、官能团兼容性和多样的反应活性,是一类重要的合成中间体,在药物化学和材料科学中发挥关键作用。烯烃硼氢化是高效、高原子经济性制备硼酸酯类化合物的常用方法。然而,尽管过渡金属催化的烯烃硼氢化反应在近几十年取得较大进展,在内烯烃双键的初始位置定点引入硼酸酯仍具有挑战,其主要原因是金属介导的竞争性双键迁移导致引入位点的不确定性(图1a)。
近日,中国科学院兰州化学物理研究所研究员吴立朋课题组与南方科技大学副研究员刘柳课题组合作,报道了在iPr2NEt存在下,以BX3(X=Cl, Br)作为硼化试剂进行烯烃硼氢化反应的新方法。iPr2NEt的加入抑制了烯烃聚合和卤硼化副反应,并为硼氢化提供“H”源(图1b)。该策略实现了在内烯烃原始双键位置引入硼酸酯,该体系应用于一系列1,n-二硼烷的合成。机理研究揭示,该反应主要通过类似FLP(受阻路易斯酸碱对)单电子转移机制的自由基反应途径。在最优条件下,研究人员对烯烃底物的适用范围进行了考察,一系列末端烯烃,包括芳基烯烃、1,1-二取代烯烃、脂肪链烯烃和生物衍生烯烃均可被硼氢化,该体系对含酮羰基、酰胺等官能团也同样适用(图2)。随后,研究人员对内烯烃固定位点选择性硼氢化反应进行研究,发现该体系可以较好地在内烯烃双键原始位置引入硼酸酯基团(图3)。
结合控制实验以及相关DFT计算结果,研究人员提出该反应主要的机理路径(图4)。BX3(X = Cl, Br)与iPr2NEt络合形成Lewis酸碱对络合物AB,在光的促进作用下生成了[BX3·]-自由基阴离子和胺基自由基阳离子,[BX3·]-自由基阴离子加成在烯烃的双键上形成了新的烷基自由基,并攫取胺基自由基的氢,生成硼氢化产物与卤负离子。
相关研究成果在线发表在《德国应用化学》上。研究工作得到国家自然科学基金、江苏省自然科学基金等的支持。
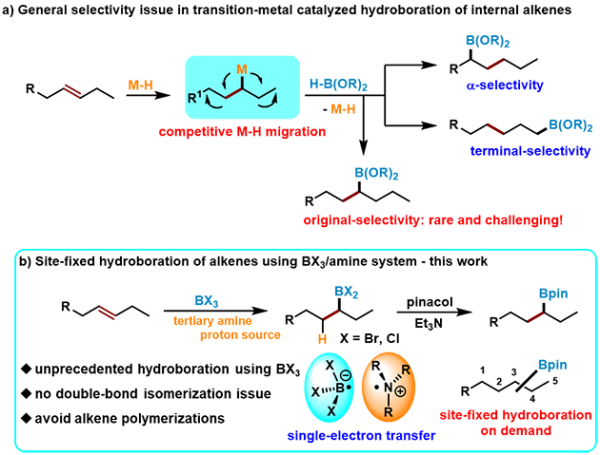
图1.烯烃固定位点选择性硼氢化反应:挑战和策略
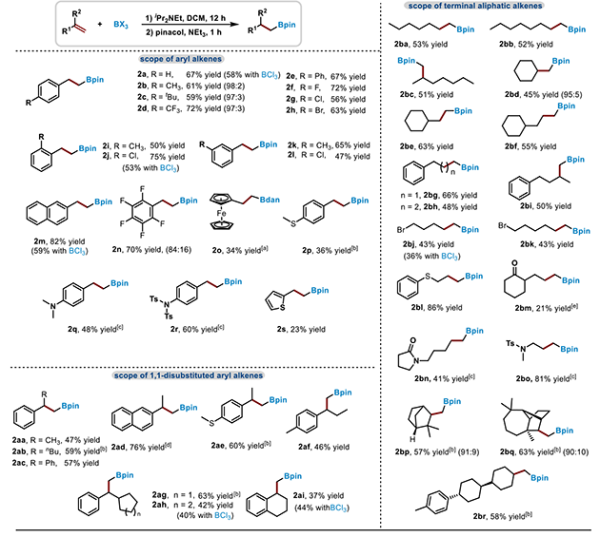
图2.末端烯烃底物拓展
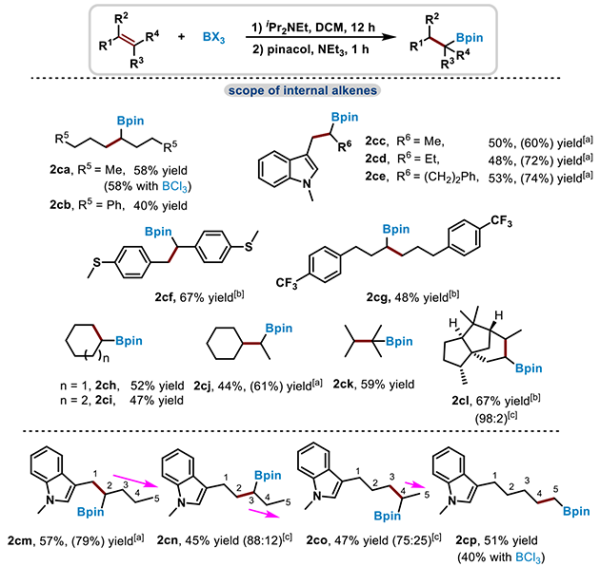
图3.内烯烃底物拓展
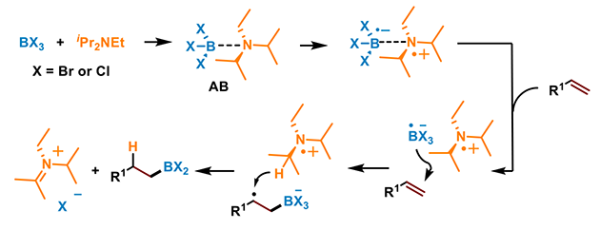
图4.推测的主要反应路径
中科院兰州化物所

|