|
近日,清华大学化工系王玉军课题组与中国科学院天津工业生物技术研究所孙周通课题组合作,通过三唑类分子和金属离子的多位点协同桥接作用,实现了诱导醇脱氢酶自聚形成具有高活性和稳定性的多孔水凝胶,填补了领域内对基于弱作用的无载体固定化酶研究的空白。
近年来,酶催化已成为可持续生产高值化学品的关键工业技术,具有出色的立体选择性和低环境足迹。然而,酶的本质柔性限制了其长期使用的稳定性。并且,其水溶性导致回收成本高昂。因此,酶催化剂通常在一次使用后被废弃,这与循环经济的原则相矛盾。生物大分子固定化技术的发展为解决这些问题提供了可能,但固定化过程难以平衡催化活性与稳定性之间的矛盾。大多数方案通过强相互作用(例如共价键)或弱相互作用(如物理吸附)将生物大分子与宿主载体结合。然而,强相互作用通常导致活性丧失甚至完全失活,而弱相互作用又存在稳定性低的缺陷。
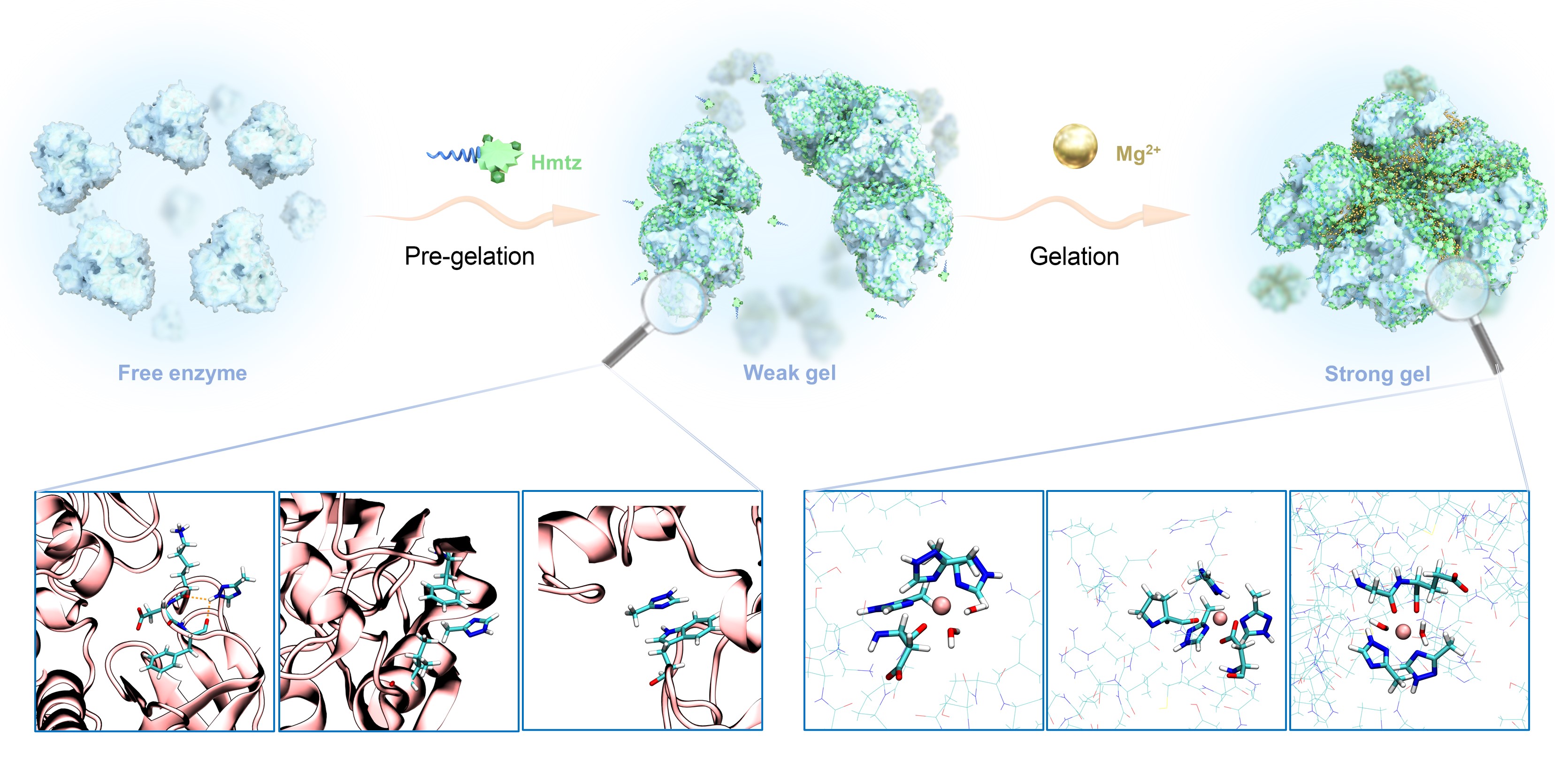
图1.酶自聚水凝胶形成过程:三唑分子诱导的预凝胶化与镁离子促进的进一步凝胶化
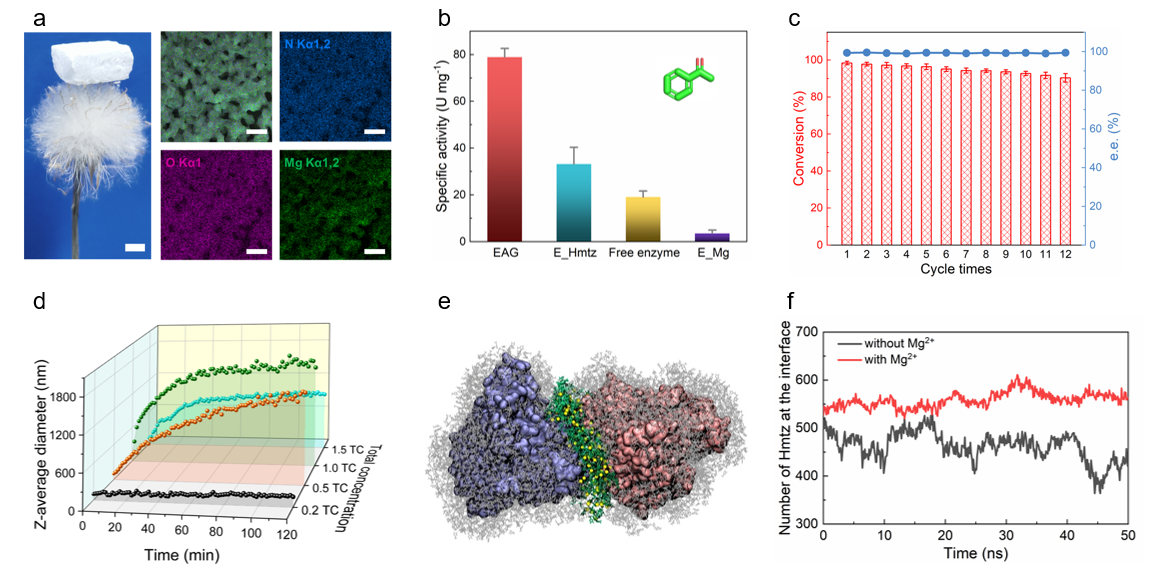
图2.酶自聚水凝胶的性能与机制解析。(a)宏微观特性;(b)催化不对称还原反应的活性比较;(c)重复使用性;(d)原位生长过程监测;(e)桥接界面;(f)镁离子对界面稳定性的影响
在这项工作中,团队将该策略(图1)制得的无载体固定化酶用于酮的不对称还原反应,取得了高于游离酶3~5倍的比活性,且具有优异的可重复使用性(图2)。进一步,团队利用冷冻电镜技术成功解析了凝胶酶的高分辨率三维结构(2.1Å)。
基于近原子级结构,团队发现,醇脱氢酶W110残基在凝胶化后发生了94.5°翻转,同时底物结合口袋显著扩大,提高了催化效率。本征动力学分析表明,根据米氏方程拟合得到的凝胶酶的kcat为15.45 s-1,达到了游离酶的6.3倍。并且还发现,镁离子的配位作用提升了酶的鲁棒性,使得凝胶化酶在高温、有机溶剂、长时间储存等不利条件下的稳定性显著增强。其中,凝胶酶的中点融化温度相比于游离酶提高了35.2°C。通过深入的机理研究,团队揭示了三唑分子与镁离子的协同作用,即三唑分子诱导的酶的弱聚界面为镁离子的多齿螯合提供了机会位点,且镁离子的配位作用能够进一步锁定界面上的三唑分子,证实了两者在酶自聚水凝胶形成过程中的不可或缺性。基于这些认识,团队成功实现了另外两种具有不同结构的醇脱氢酶的凝胶固定化,并获得了较好的重复使用性能,拓宽了该方法的应用范围。这种固定化酶的多级孔和高比活特性,有望在新型微通道酶反应器的构建中发挥重要作用。
该研究以“基于三唑类分子和金属离子的协同桥接实现高活性和稳定性的醇脱氢酶自聚水凝胶”(Active and stable alcohol dehydrogenase-assembled hydrogels via synergistic bridging of triazoles and metal ions)为题,于4月13日发表在《自然·通讯》(Nature Communications)期刊上。
清华大学化工系2019级博士生陈强为论文的第一作者,论文共同通讯作者为清华大学化工系王玉军教授、中国科学院天津工业生物技术研究所孙周通研究员。该研究得到国家重点研发计划、国家自然科学基金等项目的资助。
论文链接:
https://www.nature.com/articles/s41467-023-37921-y
清华大学化工系

|